重磅!恒瑞医药“双艾”可切除肝细胞癌研究同步亮相ESMO口头报告与《柳叶刀》主刊
10月19日,恒瑞医药自主研发的PD-1抑制剂卡瑞利珠单抗(艾瑞卡®联合阿帕替尼(艾坦®(“双艾”组合一项可切除肝细胞癌(HCC研究(CARES-009亮相2025年欧洲肿瘤内科学会(ESMO大会口头报告1环节,并同步发表于****医学期刊《柳叶刀》主刊2。
CARES-009研究是一项“围术期卡瑞利珠单抗联合阿帕替尼(“双艾”组合对比单纯手术**伴中高危复发风险可切除肝细胞癌(HCC的**多**、随机、开放、平行对照研究”,由复旦大学附属中山医院樊嘉院士指导,复旦大学附属中山医院周俭教授牵头,联合**16家**共同开展。
周俭教授在大会现场正式公布了CARES-009研究的重磅成果1。该研究是全球**可切除HCC围术期**方案取得阳性结果的3期研究,结果显示,围术期卡瑞利珠单抗联合阿帕替尼相比单纯手术显著改善了伴中高危复发风险可切除HCC的无事件生存期(EFS,突破42个月(42.1个月 vs 19.4个月,HR 0.59;95% CI,0.41-0.85;p=0.0040,为众多**患者带来了新的曙光。

2025 ESMO现场图:周俭教授进行口头报告

CARES-009研究同步发表于《柳叶刀》主刊
01.研究背景
目前可切除肝细胞癌无标准围术期**方案。超过80%的HCC患者在**切除术后都会复发3,特别是存在高危复发风险时,如单个肿瘤体积大、多病灶或血管侵犯等,这仍然是HCC的重大挑战4。IMbrave050研究显示仅术后辅助**可能并不能给**患者带来临床获益,因为早期的无复发生存期(RFS优势在后期的随访中并不能维持5-6,而围手术期的**可以整合新辅助和辅助阶段的潜在获益,在新辅助**阶段可能利用完整的肿瘤作为抗原,从而增强抗肿瘤免疫效应的概率;辅助**靶向残留病灶,可能再次激活免疫系统并促进免疫记忆7。
在CARES-310研究中,恒瑞医药创新药卡瑞利珠单抗联合阿帕替尼相比索拉非尼显著改善了不可切除HCC患者的总生存期(OS,中位OS长达23.8个月8-9。CARES-009研究旨在进一步评估围术期卡瑞利珠单抗联合阿帕替尼对比单纯手术用于伴中高危复发风险的可切除HCC患者的疗效和安全性。
02.研究方法
CARES-009研究是一项**多**、随机、开放、平行对照的3期临床研究(ClinicalTrials.gov,NCT04521153,****分期(CNLCIb-IIIa期可切除HCC患者按照1:1随机分配到围手术组或单纯手术组,随机分层因素为CNLC分期(Ib vs IIa/IIb vs IIIa和乙肝病毒(HBV感染状态(HBV阳性 vs HBV阴性。围手术组接受2个周期的新辅助卡瑞利珠单抗(200mg,iv,q2w联合阿帕替尼(250mg,qd**,新辅助末次**1-2周后手术,手术后4-8周开始术后辅助卡瑞利珠单抗(200mg,iv,q3w联合阿帕替尼(250mg,qd**,术前术后**一年;单纯手术组随机后直接手术,术后观察;两组均允许患者术后做一次预防性经动脉化疗栓塞(TACE**。
主要研究终点为研究者评估的EFS(根据RECIST v1.1,关键次要终点为主要病理缓解(MPR,定义为残留肿瘤活性细胞比例≤50%率和OS,其他次要终点包括R0切除率、**病理缓解(pCR率、无病生存期(DFS、盲态独立评审委员会(BIRC评估的EFS、安全性等。
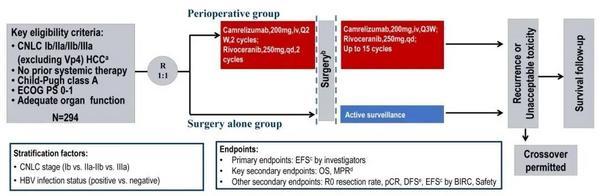
图1. CARES-009研究设计
03.研究结果
1.基线特征
自2021年3月25日至2024年1月29日,共随机294例受试者,围手术组148例,单纯手术组146例。围手术组和单纯手术组的基线人口统计学和临床特征均平衡,两组的中位年龄分别为58和59岁;大部分患者为男性(88% vs 86%,ECOG 0分(98% vs 99%,HBV感染(76% vs 78%,肿瘤**直径>5cm(68% vs 71%,单病灶(55% vs 58%。两组不同CNCL分期、巴塞罗那分期(BCLC的患者人数相当,CNCL Ib期为55% vs 58%,CNCL IIa期28% vs 29%,CNCL IIb期3% vs 2%,CNCL IIIa期为14% vs 12%;BCLC A期为53% vs 58%,BCLC B期为31% vs 29%,BCLC C期为16% vs 13%。
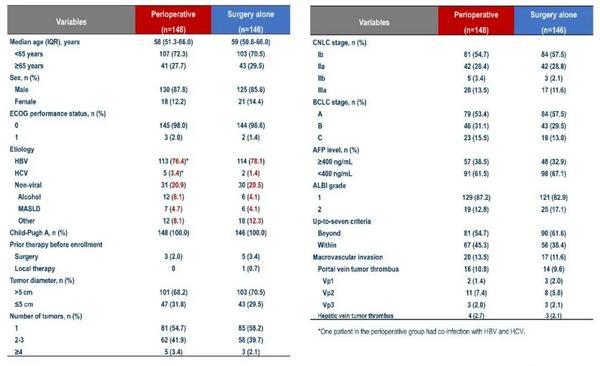
表1. 患者基线特征
2.临床疗效
截至2025年3月20日,中位随访时间21.3个月(四分位数:16.3-33.1,卡瑞利珠单抗和甲磺酸阿帕替尼可显著延长研究者评估的EFS(42.1个月 vs 19.4个月,HR 0.59;95% CI,0.41-0.85;p=0.0040,p值低于预设有效性界值0.0148,取得阳性结果。盲态独立评审会员会(BIRC评估的EFS(NR vs 19.4个月,HR 0.63;95% CI,0.44-0.90趋势和研究者评估的EFS一致。

图2. 研究者评估的EFS

图3. BIRC评估的EFS
围手术组的EFS获益在大多数预设的亚组中基本一致,包括伴中危复发风险和高危复发风险的患者。
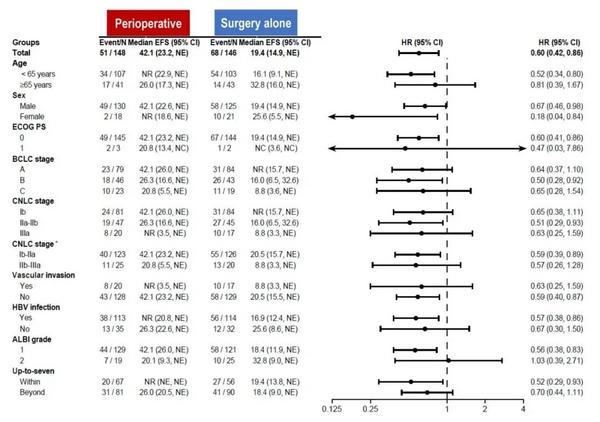
图4. 研究者评估的EFS森林图
围术期**组35.1%的受试者(包括3.4%的pCR患者经过2周期卡瑞利珠单抗和阿帕替尼**后,观察到MPR,而单纯手术组仅为7.5%(p<0.001。

表2. 不同cut off值的病理缓解情况
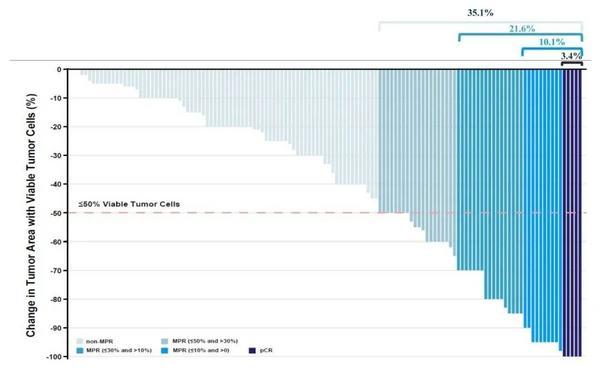
图5. 围手术组的病理缓解深度
与单纯手术组相比,研究者和BIRC评估的围术期**组DFS均有延长。
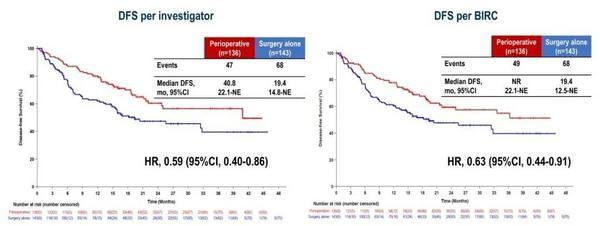
图6. 研究者评估和BIRC评估的DFS
3.安全性
围手术期**组未发现新的安全信号。
04.总结与展望
CARES-009研究是全球**可切除HCC围术期**方案取得阳性结果的3期研究,围术期卡瑞利珠单抗联合阿帕替尼相比单纯手术显著改善了伴中高危复发风险可切除HCC的EFS,显示出更高的MPR率。该研究的OS数据尚不成熟,仍在随访中。
此次CARES-009研究结果为众多**患者带来了新的曙光,也为全球**诊疗体系贡献了具有影响力的“**智慧”和“**方案”,有望成为**围术期标准**方案,开启**围术期靶向联合免疫**的新**。
卡瑞利珠单抗(商品名:艾瑞卡®是恒瑞医药自主研发的一款人源化PD-1单克隆抗体,于2019年5月获批在**上市。目前已在肺癌、**、食管癌、鼻咽癌以及宫颈癌等瘤种中获批多项适应症,为获批适应症和覆盖瘤种数量**的国产PD-1产品。阿帕替尼(商品名:艾坦®是恒瑞医药开发的一款针对血管内皮生长因子受体(VEGFR的小分子酪氨酸激酶抑制剂,于2014年10月获批在**上市,目前已在**、**、乳腺癌领域获批4项适应症。
卡瑞利珠单抗(艾瑞卡®联合阿帕替尼(艾坦®(“双艾”组合已于2023年初获得**药监局批准用于一线**晚期肝细胞癌,这是全球**获批用于不可切除肝细胞癌患者一线**的PD-1抑制剂与小分子酪氨酸激酶抑制剂(TKI的组合。除了****领域,“双艾”组合还在**、胆道癌、黑色素瘤、乳腺癌和肺癌等不同瘤种进行研究,有望造福更多肿瘤患者。
未来,恒瑞医药将继续坚持“以患者为**”的理念,针对**高发肿瘤领域持续推进创新研发,力争研制出更多更好的新药、好药,服务健康**,惠及全球患者。
参考文献:
[1]Jian Zhou, et al. Perioperative camrelizumab plus rivoceranib versus surgery alone in patients with resectable hepatocellular carcinoma at intermediate or high-risk of recurrence (CARES-009: a randomized phase 3 trial. 2025 ESMO 1470O.
[2]Wang Z, Fan J, Zhou S, et al. Perioperative camrelizumab plus rivoceranib versus surgery alone in patients with resectable hepatocellular carcinoma at intermediate or high risk of recurrence (CARES-009: a randomised phase 2/3 trial. Lancet 2025. Published Online. https://doi.org/10.1016/S0140-6736(2501720-9.
[3]Vogel A, Meyer T, Sapisochin G, Salem R, Saborowski A.Hepatocellular carcinoma. Lancet 2022; 400: 1345–62.
[4]Zheng J, Chou JF, Gönen M, et al. Prediction of hepatocellular carcinoma recurrence beyond Milan criteria after resection: validation of a clinical risk score in an international cohort. Ann Surg 2017; 266: 693–701.
[5]Qin S, Chen M, Cheng AL, et al. Atezolizumab plus bevacizumab versus active surveillance in patients with resected or ablated high-risk hepatocellular carcinoma (IMbrave050: a randomised, open-label, multicentre, phase 3 trial. Lancet 2023; 402: 1835–47.
[6]Yopp A, Kudo M, Chen M, et al. LBA39 Updated efficacy and safety data from IMbrave050: phase III study of adjuvant atezolizumab (atezo bevacizumab (bev vs active surveillance in patients (pts with resected or ablated high-risk hepatocellular carcinoma (HCC. Ann Oncol 2024; 35: S1230.
[7]Llovet JM, Pinyol R, Yarchoan M, et al. Adjuvant and neoadjuvant immunotherapies in hepatocellular carcinoma. Nat Rev Clin Oncol 2024; 21: 294–311.
[8]Qin S, Chan SL, Gu S, et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310: a randomised, open-label, international phase 3 study. Lancet 2023; 402: 1133–46.
[9]Vogel A, Chan SL, Ren Z, et al. Camrelizumab plus rivoceranib vs sorafenib as first-line therapy for unresectable hepatocellular carcinoma (uHCC: final overall survival analysis of the phase 3 CARES-310 study. J Clin Oncol 2024; 42 (suppl: 4110.
张紫祎